加强药品的上市后监测,从上市早期开始!
发布日期:2021-07-20 来源:GVP365为方便您快速了解,以下为本篇要点
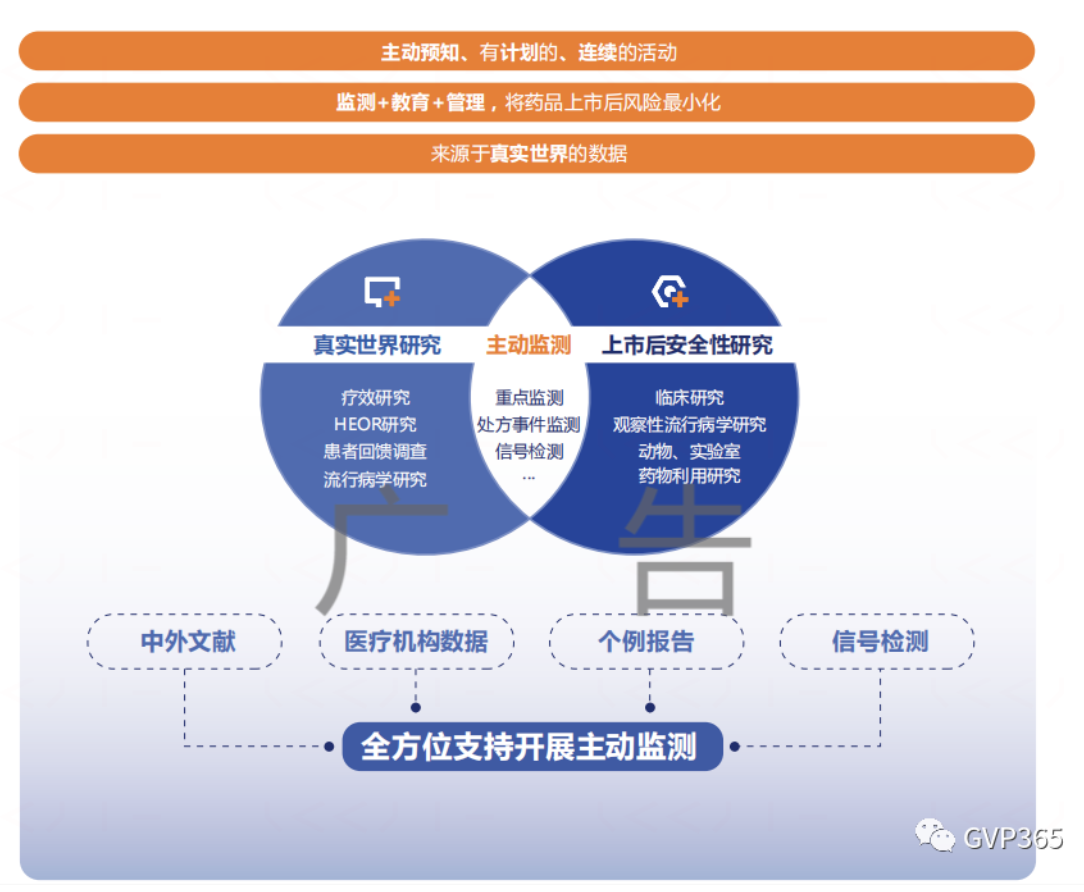
加强上市后监测是一种主动监测
采取多种措施强化各方报告意识
【原文】
第三十九条 对于创新药、改良型新药、省级及以上药品监督管理部门或药品不良反应监测机构要求关注的品种,持有人应当根据品种安全性特征加强药品上市后监测,在上市早期通过在药品说明书、包装、标签中进行标识等药物警戒活动,强化医疗机构、药品生产企业、药品经营企业和患者对疑似药品不良反应信息的报告意识。
【理解】
1、为什么需要加强上市后的监测
临床试验由于病例少,试验过程短,对试验对象的要求和用药条件控制严格,以及试验目的单纯等因素,对不良反应发生率低及在特殊人群中才能发生的不良反应不易被发现。因此需加强药品上市后的监测有利于及时发现各种类型的不良反应,特别是严重的和罕见的不良反应,及其发生频率。
2、加强上市后监测范围
创新药、改良型新药,因药品安全性信息积累较少,风险未明确,因此除了通过常规的途径收集安全性信息,持有人还应根据品种安全性特征加强主动监测,以观察上市后药品在广泛人群使用情况下的不良反应。
监管机构要求关注的品种,因监管层面的考虑,除了GMP检查时被重点关注,在今后的GVP检查中也可能是着重检查的对象,如是否开展额外的上市后监测活动及相应的活动记录均可能被关注。
3、加强上市后监测的方式
加强指的是除了建立常规的安全信息收集途径,持有人应主动开展有一定规模的上市后安全性研究,收集真实世界中的安全性信息,如下:
■ 药品重点监测,是指为进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。根据信息收集的形式的不同,可采用住院患者集中监测、登记-回访和问卷调查等方法。
■ 处方监测,向开处方的医生或患者发送随访调查问卷,以获得预后信息。在调查问卷中可以收集人口统计学特征、治疗的适应症、治疗的持续时间(包括开始时间)、记录、临床事件,以及中止治疗等信息,处方监测适宜用于产品上市早期的安全性收集,可以从大量医生和(或)患者处收集不良事件的更详细信息。
■ 注册登记研究,是指有组织地在特定疾病、病情或暴露的群体中,使用观察性方法收集特定结局的数据的方法。患者登记可用于研究特定群体的药品暴露情况,比如孕妇。可以长期随访患者,并使用标准化的问卷收集不良事件。
4、提供有效途径,强化报告意识
鉴于目前国内的药物警戒生态,无论是医疗专业人士,还是患者/消费者,对于不良反应的报告意识尚未完全建立,或不知道不良反应可以报告,或对已发生的不良反应不够重视,或无法找到相关的报告途径。
主动监测服务
因此,持有人可能需要采取以下行动,来强化潜在报告者的报告意识,也是持有人加强药品上市后监测的体现。
■ 在药品说明书、包装、标签、门户网站等地方标识联系电话或邮箱等联系方式,给予医疗机构、药品生产企业、药品经营企业和患者等潜在的报告人员提醒,并且确保途径通畅;
■ 加强与医疗机构、药品经营企业和药品生产企业的沟通,对于药品经营企业和药品生产企业,亦可采取合同约束的方法;
■ 引导医疗专业人士在就诊过程中,与患者沟通用药情况,以收集安全性信息。
【实践影响】
持有人应根据持有品种的安全性特征,在产品注册审批前需考虑是否需要开展主动监测,以何种方式开展主动监测。
【延伸阅读】
《生产企业药品重点监测工作指南》
《GVP module VIII》

相关文章
标签 药物警戒
- 短效避孕药怎么选?用药注意事项看这篇2025-03-30
- “第五届药物警戒生态建设学术研讨会”圆满落幕2024-07-30
- 2022药物警戒生态建设学术研讨暨“医疗机构药物警戒体系建设专家共识”发布会成功召开2022-07-05
- 药物警戒PV知识:什么是严重药品不良反应?2022-02-11
- 药物警戒PV知识:什么是严重药品不良反应?2022-02-11





